Am 9. Dezember kündigte die Europäische Kommission die Verlängerung der Gültigkeitsdauer der Zertifikate für Legacy-Produkte auf dem Europäischen Markt an. Dies hat bei einigen Herstellern von Medizinprodukten zu Unsicherheiten und Ratlosigkeit bezüglich der EUDAMED-Fristen geführt.
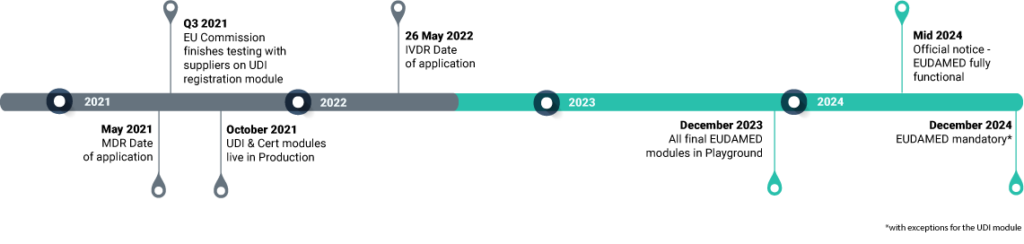
Wie die Europäische Kommission am 15. Dezember 2022 bei einem Treffen mit den EU Mitgliedstaaten, den Vertretern der Industrie und der benannten Stellen bestätigte, sind die EUDAMED-Fristen von dieser Verlängerung NICHT betroffen. Es gibt keine weitere Verzögerung bei den EUDAMED-Fristen, die unverändert bleiben!
Die einzige Auswirkung dieses Legislativvorschlags auf EUDAMED besteht darin, dass die Hersteller mehr Legacy-Produkte als geplant registrieren müssen – ein wichtiger Schritt, der bei der Aufbereitung der Daten für EUDAMED zu berücksichtigen ist. Einschließlich der Attributanalyse des Datenmodells für Legacy Produkte, die einige wichtige Unterschiede zu den regulierten Produkten aufweist.
Zur Erinnerung: Der Gesetzesvorschlag der EU-Kommission beinhaltet:
- Eine Verlängerung der Übergangsfrist für Legacy-Produkte auf dem Markt mit gültigen Richtlinienzertifikaten ab Mai 2024 für 2027 (Klasse III und IIb) und 2028 für andere Produkte
- Unter bestimmten Bedingungen Verlängerung der Gültigkeit von Richtlinienzertifikaten
- Aufhebung der “Ausverkaufsklausel” vom Mai 2025
Darüber hinaus wird eine Zwischenlösung benötigt, bis die Gesetzesänderung erfolgt ist. Im Rahmen des Scopings müssen noch 23 000 Zertifikate auf die MDR/IVDR umgestellt werden.

Suchen Sie noch nach der die richtige Strategie für die EUDAMED-Registrierung Ihrer Medizinprodukte? Wenden Sie sich an unser Expertenteam, egal ob Sie hunderte von Medizinprodukten verwalten oder nur einige wenige in EUDAMED registrieren wollen. atrify unterstützt Sie den den optimalen Weg zu finden, Ihre Daten bei EUDAMED einzureichen und erfolgreich zu registrieren!
On December 9th the European Commission announced the extension of the validity of legacy devices certificates in the European market. This has led to confusion and uncertainties among medical device manufacturers regarding the EUDAMED deadlines.
This was clarified on December 15th by the European Commission when meeting with Member States, Notified Bodies and representatives of the Industry. The Commission confirmed EUDAMED deadlines are NOT affected by the certificate extension! There is no further delay in the EUDAMED deadlines that remain unchanged!
The only impact of this legislative proposal on EUDAMED is the need for manufacturers to register more legacy devices than planned – which is an important step to take into consideration when preparing data for EUDAMED (including the attribute analysis of the Legacy device data model, which has some important differences compared with regulated devices)
Reminder: the legislative proposal from the EU Commission includes:
- An extension of the Transitional period for legacy devices on the market with valid Directive certificates from May 2024 for 2027 (Class III and IIb) and 2028 for other devices.
- Under certain conditions, extensions of Directive certificates validity
- Removal of the “sell off provision” of May 2025
In addition, an interim solution is needed until the legislative change takes place. In terms of scope, 23 000 certificates still need to be transitioned to the MDR/IVDR
Are you struggling with finding the right strategy for the EUDAMED registration of your medical devices? Contact our team of experts regardless of whether you have hundreds of devices or you just want to register a few items in EUDAMED. atrify will support you tackling your challenge and finding the optimal way to submit your data to EUDAMED!




